猪圆环病毒II型(PCV2)是给猪场带来经济损失的主要病毒之一。它导致多种疾病,一般总称为圆环病毒病(PCVD)。第一个PCV2疫苗于2004年面世,现在大多数的猪场都进行PCV2免疫。在西班牙,这个欧盟之内第二大养猪国家,总存栏2400万生猪中80%免疫了PCV2。在北美地区,PCV2疫苗的覆盖率还要更高。


最近我们的研究小组在关注一个有趣的问题,疫苗所诱导的免疫对PCV2的进化存在什么样的影响?实际上,最近已经有一些研究结果表明, 目前在商业猪场有新的不同变种的PCV2在流行(Kekarainen等,2014)。在无论是免疫PCV2疫苗的场还是不免疫的场,都存在不同频率和基因组不同位置变异的PCV2。此外,所发现的变异中有一些氨基酸的改变是发生在抗原表位区,而这个区域的氨基酸序列对于免疫系统的激活非常重要。
我们将进行的研究中将采用“下一代测序技术(NGS,next generation sequencing)”对PCV2的序列进行分析,这使得我们能够鉴别出很多低频率的变异。这些低频率变异在传统测序方法下无法被识别,但是在PCV2的感染、传播尤其是在PCV2的进化中却发挥很大作用。下一代测序技术的优势是可以获取大量的信息,然后采用生物信息学分析方法对数据进行分析,可以实现在全基因组水平上对所有的病毒群体进行研究。 目前这项技术已经应用在研究免疫和抗药性对病毒进化的影响(Grad et al., 2014; Ortega-Prieto et al., 2013; Tsibris et al., 2009)。
那么是什么促使我们选择PCV2作为疫苗驱动基因变异的研究对象呢?是因为PCV2的以下特点让我们做出决定:
- PCV2可以通过积累点变异和重组来获取遗传变异。实际上,相对于其他DNA病毒来说,PCV2的变异速度超出人们的预期(1.2x10−3 个替换每个位点每年),已经与RNA病毒的变异速度接近(Firth et al., 2009)。
- 历史数据显示PCV2的主导型在波动。根据PCV2衣壳基因的不同,PCV2被划分为三种型,分别为a、b和c型(Segalés et al., 2008)。PCV2的主导型曾经从a型转变成了b型,巧合的是,全球不同地区这个转变完成时都伴随着严重圆环病毒病的爆发 (Carman et al., 2006; Cortey et al., 2011; Cheung et al., 2007)。虽然现有的数据不能直接证明这些爆发是由PCV2b毒株导致,但是在时间和地点上的如此巧合或许可以帮助我们理解PCV2主导型的进化难题(Segalés et al., 2013)。只是目前无法圆满解释的是PCV2a和PCVb之间毒力差距并不明显(Opriessnig et al., 2008)。
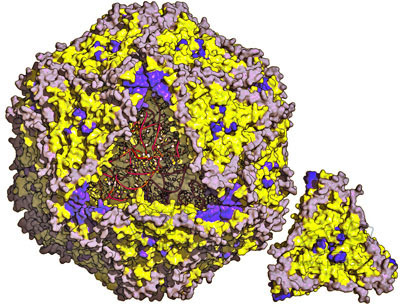
PCV2病毒颗粒的结构。PCV2完整衣壳的表面沿着三折轴投射。图中三角形位置被切去的部分(右下角)是衣壳蛋白的壳粒三聚体,用于显示病毒颗粒的内部结构。 蛋白质数据银行编号:3R0R.
- 最近,有新的PCV2变株被发现,这也增加了我们研究PCV2新毒株出现可能性的兴趣(Opriessnig et al., 2013)。实际上,在中国已经在猪上发现了独立很强的PCV2b(Guo等2012),目前还不知道是否同时有其他类型的强毒株在流行。
- 在主要的养猪国家,PCV2疫苗都在广泛使用。但是现在所有商用疫苗都无法引起消除性免疫力。也就是说,虽然疫苗可以给动物提供保护,但是猪仍然会感染PCV2。这些疫苗的存在结合PCV2自身的分子生物学特点,就相当于给PCV2在猪体内提供了一个筛选和进化的空间。在一些极端情况下注射疫苗反而会使PCV2可以逃脱猪的免疫识别。
- 我们之前的研究表明,不同猪场所流行的PCV2有多种,而PCV2免疫的猪场与不免疫的猪场所流行的PCV2毒株不同(Kekarainen et al., 2014)。
总之,尽管目前PCV2疫苗拥有高的保护率,并且能够很好的投资回报(Beach and Meng, 2012),但是只要免疫猪群中还会存在PCV2病毒,我们就不能忘记PCV2疫苗对于PCV2病毒进化的影响。
(翻译:曹杰)
本站所有技术文章均拥有版权,未经本站允许请勿擅自转载。



